Notícia de Última Hora - Resultados Preliminares da Fase 1 do TransCon CNP
Jan Mikkelsen, o Presidente e CEO da Ascendis Pharma, declarou que "Os resultados do TransCon CNP apresentados indicaram pela primeira vez que o nosso possível produto resultou na exposição contínua dos pacientes ao CNP a níveis terapêuticos durante sete dias, permitindo a administração do mesmo semanalmente. Acreditamos que o TransCon CNP é adequado para enfrentar os desafios que as pessoas que vivem com acondroplasia sentem, e representa uma potencial opção terapêutica nova destinada para além da questão da altura, para enfrentar comorbilidades associadas. Estamos ansiosos por avançar com este programa para os ensaios clínicos em crianças que vivem com acondroplasia no próximo ano, 2019". A noticia completa e a apresentação dos dados preliminares de fase 1 podem ser vistos no website da Ascendis Pharma.

| Créditos - Ascendis Pharma (dados preliminares de fase 1). |
Ensaio clínico de fase 1
Foi:
- Duplo-cego;
- Aleatorizado;
- Controlado por placebo.
Design de Fase 1

| Design de fase 1. Créditos: Ascendis Pharma (Dados preliminares de fase 1). |
No ensaio participaram 45 adultos saudáveis em 2 centros de estudo na Austrália, que foram divididos em grupos diferentes. Foram testadas 5 doses de Transcon CNP, sequencialmente, começando com a dose mais baixa: 3.0, 10, 25, 75 e 150 microgramas/kg. Em cada coorte (correspondente a cada dose) foram aleatorizados 10 participantes que receberam o TransCon CNP ou o placebo, num rácio de 4:1. Cada coorte completou a dosagem e um Comité de Monitorização da Segurança dos Dados (DSMB) reviu os dados duplo-cegos para aprovarem o aumento para a próxima dose mais elevada.
O endpoint primário foi a frequência de eventos adversos depois da administração do medicamento.
Os endpoints secundários incluíram parâmetros de segurança adicionais, tolerância e farmacocinética.
Resultados preliminares de segurança para o TransCon CNP
Os aspetos chave dos dados apresentados pela Ascendis foi que não se observou nenhum Evento Adverso sério ou efeito indesejáveis.
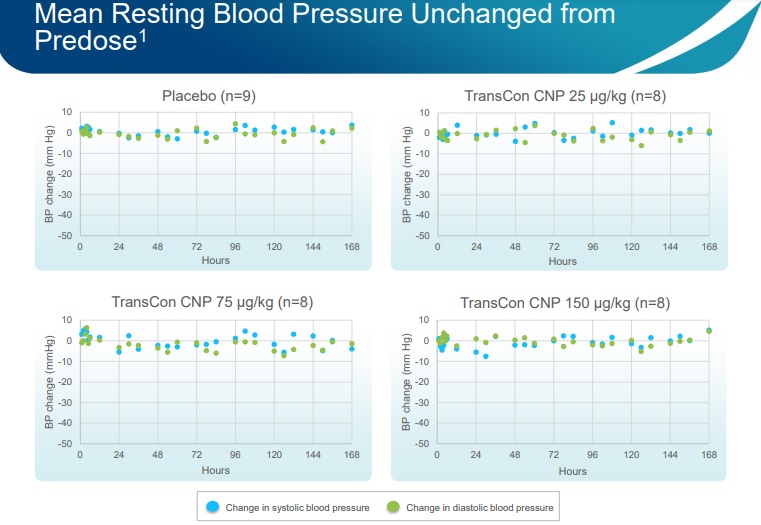
Para além disso, a empresa reportou que o TransCon CNP foi geralmente bem tolerado em doses até 150 µg/kg. Comparando a pressão sanguínea em repouso (medida quando a pessoa não está a fazer nada) e a frequência cardíaca com os resultados de um composto semelhante, o Vosoritide, agora em fase 3, que está a ser administrado a 15 µg/kg/dia, estes parâmetros mantiveram-se inalterados relativamente ao medido antes do doseamento em todos os coortes. Comparando com o Vosoritide, isto é um parâmetro importante, visto que este causa reduções na frequência cardíaca e na pressão sanguínea não-sérias, transientes (duram uns minutos) e resolvidas sem intervenção médica.
A Ascendis ainda reportou que as injeções foram bem toleradas em todos os coortes (em cada dose) sem eventos adversos devidos à injeção.
Conclusões principais
1. Os resultados da fase 1 do TransCon CNP reproduziram o perfil farmacocinético e de segurança cardiovascular dos estudos pré-clínicos;
Esta frase significa que os resultados obtidos agora são concordantes com os obtidos anteriormente no modelo de ratinho.
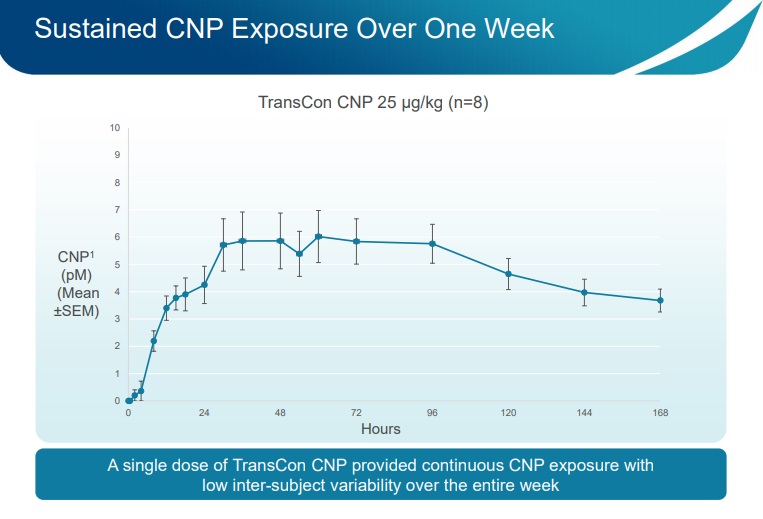
2. O método de administração de uma administração subcutânia (injeção de TransCon CNP) por semana foi confirmado através dos valores de CNP contínuos ao longo de sete dias;
3. Os níveis contínuos de CNP são importantes para equilibrar as vias do CNP/FGFR3 e normalizar o crescimento;
4. Foi geralmente bem tolerado em todos os coortes;
5. Tem potencial para causar um impacto significativo nas vidas dos pacientes, não só afetando a altura, mas também abordando várias comorbilidades associadas com a acondroplasia.
Apresentação da Ascendis Pharma completa aqui.
Fontes


