[Texto Completo Grátis] Desenvolvimento e crescimento defeituoso da mandíbula na acondroplasia
Um embrião é um novo organismo no seu estado de desenvolvimento inicial. Nos humanos é definido como o organismo em desenvolvimento desde o quarto dia após a fertilização (quando a união entre o ovo humano e o espermatozoide ocorre) até à oitava semana de gravidez. Depois disso, o bebé por nascer é normalmente designado por feto.
Muita da maquinaria de desenvolvimento do embrião (as estruturas celulares) usada no desenvolvimento humano é semelhante ao usado por outros animais. A maquinaria é essencial para quatro processos: a proliferação celular (multiplicação), a especialização celular (definição do tipo de célula no qual cada célula se transformará), a interação celular e o movimento celular. Durante estes processos, cerca de 20 000-25 000 genes do genoma humano produzem à volta de 100 000 proteínas diferentes, que dão forma e substância ao feto.
Os arcos faríngeos (o mesmo que o arco braquial, "Braquial" vem do grego e quer dizer guelra) são uma série de bandas de tecido anterior (mais próximo do corpo) visível do exterior que se encontra abaixo do cérebro precoce e resulta nas estruturas da cabeça e do pescoço.
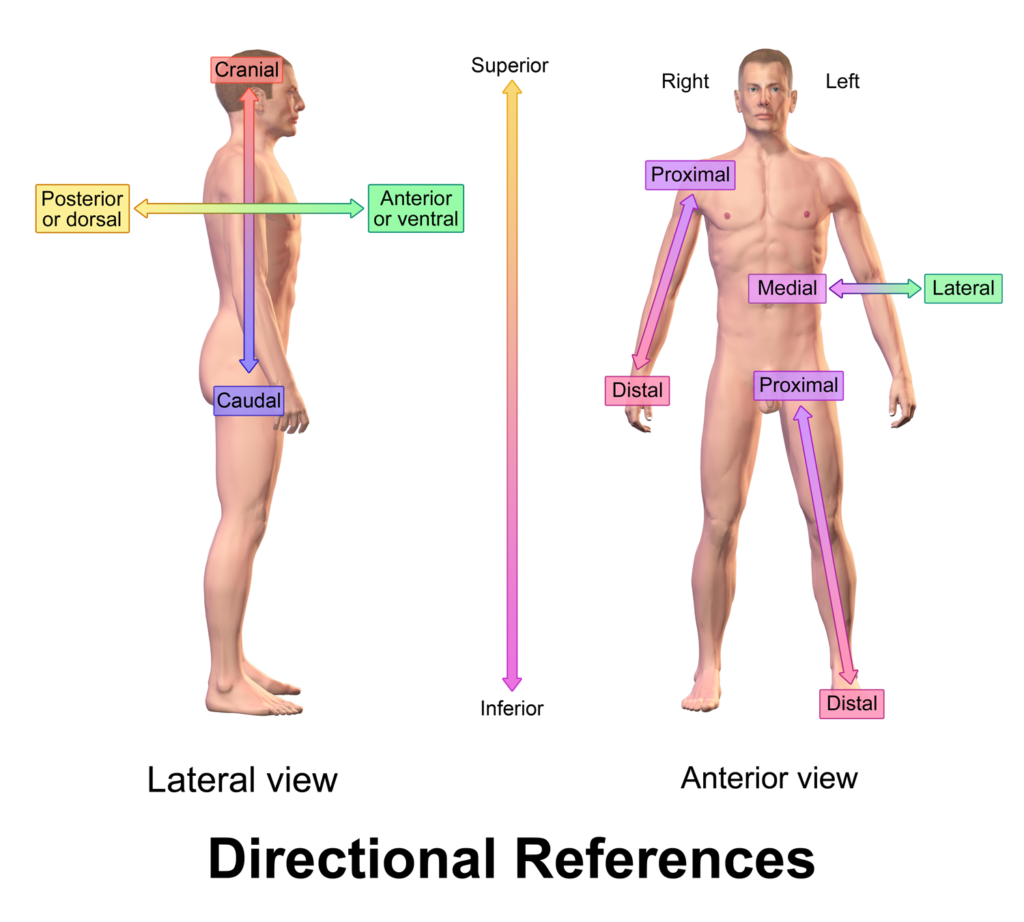
| Créditos: Anatomic terms of location -Wikipedia. |
Cada arco é formado inicialmente por componentes semelhantes que se vão diferenciar (vão ser convertidos noutros tipos de tecidos) para formarem estruturas diferentes da cabeça e do pescoço. Nos humanos são formados cinco arcos.
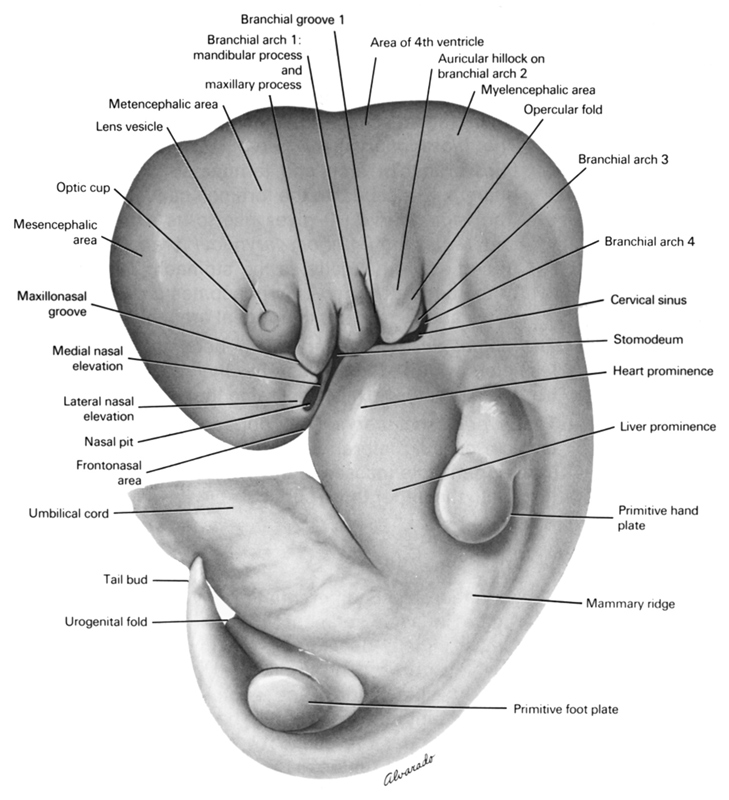
| embrião humano com 10mm, com 5 semanas. Créditos: The virtual Human Atlas. |
O arco 1 (arch 1 na imagem) está na origem de uma cartilagem específica, designada a cartilagem de Meckel.
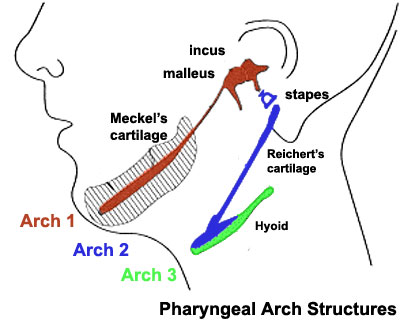
| Créditos: Embryology online education and research website. |
Esta introdução foi feita para enquadrar o estudo seguinte feito por Laurence Legeai-Mallet et al.: Meckel's and condylar cartilages anomalies in achondroplasia result in defective development and growth of the mandible, HMG Advance Access published June 3, 2016
"O crescimento mandibular depende em grande parte das cartilagens primária e secundária. A cartilagem de Meckel (MC) é uma cartilagem em forma de bastão que segue o processo mandibular do primeiro arco faríngeo e atua como um molde para a ossificação membranar do corpo da mandíbula."
Este estudo segue-se à primeira publicação do NVP-BGJ398.
"As mutações que ativam o FGFR3 no humano resultam na acondroplasia (ACH), a forma de nanismo mais frequente, onde as cartilagens são gravemente perturbadas causando defeitos em: ossos longos, base do crânio e vértebras. Visto que o desenvolvimento e crescimento mandibular depende em cartilagens que guiam ou participam diretamente no processo de ossificação, investigámos o impacto das mutações do FGFR3 na forma, tamanho e posição da mandíbula."
"mostramos que as mutações que ativam o FGFR3 levam a anomalias estruturais das cartilagens primárias (de Meckel) e secundárias (condilares) da mandíbula, resultando na hipoplasia e dismorfologia da mandíbula."
"Estes defeitos estão provavelmente relacionados com a proliferação e diferenciação defeituosa dos condrócitos."
"O inibidor da tirosina quinase pan-FGFR NVP-BGJ398 corrige os defeitos nas cartilagens de Meckel e condilares ex vivo. Para além disso, mostramos que uma dose baixa de NVP-BGJ398 melhora o crescimento condilar in vivo e corrige dismorfologias em ratinhos Fgfr3Y367C/+, o que sugere que o tratamento pós-natal de ratinhos com NVP-BGJ398 pode oferecer uma nova estratégia terapêutica para melhorar as anomalias mandibulares em ACH e outras condições relacionadas com o FGFR3"
As principais observações deste estudo são as seguintes:
- A acondroplasia resulta na hipoplasia e dismorfologia da mandíbula
- A ativação do FGFR3 em ratinhos resulta na hipoplasia e dismorfologia da mandíbula
- A homeostase dos condrócitos está distribuída na cartilagem de Meckel de ratinhos Fgfr3Y367C/+
- A ativação do FGFR3 reduz o crescimento condilar em humanos e ratinhos
- A inibição das tirosina quinases corrige os defeitos nas cartilagens primária e secundária em embriões Fgfr3Y367C/+
- A inibição das tirosina quinases melhoram a dismorfologia mandibular e o tamanho dos condilos em ratinhos Fgfr3Y367C/+
Este estudo é mais uma afirmação de que o novo NVP-BGJ398 pode ser um tratamento potencial para a acondroplasia, mas ainda é preciso investigar muita coisa sobre ele. Em termos de especificidade do FGFR3 (o composto não será elegível se afetar outras enzimas importantes para o desenvolvimento natural de uma criança com acondroplasia), toxicidade, disponibilidade e eficácia no acesso à placa de crescimento de pacientes com acondroplasia.


