[Todo el Texto Libre] Desarrollo deficiente y crecimiento de la mandíbula en la acondroplasia
Un embrión es un nuevo organismo en la etapa más temprana del desarrollo. En los humanos, este se define como el organismo en desarrollo desde el cuarto día después de la fecundación (cuando se produce la unión de un óvulo humano y un espermatozoide) hasta el final de la octava semana de embarazo. Pasado ese tiempo, generalmente al bebé no nacido se le llama feto.
Gran parte de la maquinaria de desarrollo embrionario (el aparato celular) utilizada en el desarrollo humano es similar a la utilizada por otros animales. La maquinaria es esencial para cuatro procesos celulares: proliferación (multiplicación), especialización (definición del tipo de célula en que se convertirá cada célula), interacción y movimiento. Durante estos procesos, aproximadamente 20,000-25,000 genes en el genoma humano dan lugar a hasta 100,000 proteínas diferentes, que dan forma y sustancia al feto.
Los arcos faríngeos (o arcos branquiales, palabra que proviene del griego y significa branquias) son una serie de bandas de tejido anterior (más apegados al cuerpo) externamente visibles que se encuentran debajo del cerebro temprano y dan origen a las estructuras de la cabeza y el cuello.
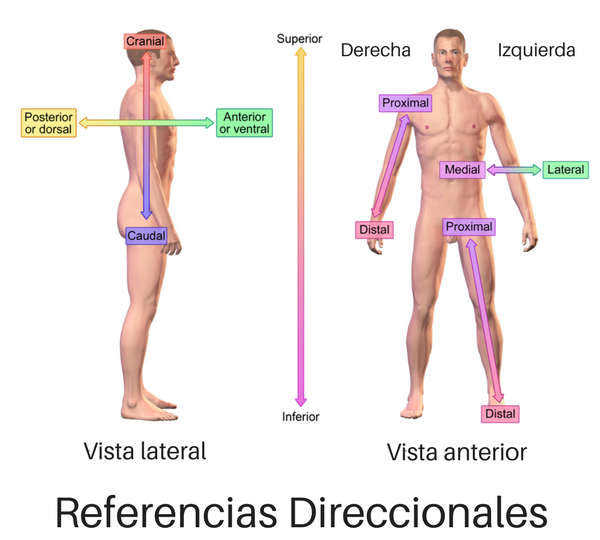
| Créditos: Términos anatómicos de localización -Wikipedia. |
Cada arco inicialmente formado a partir de componentes similares se diferenciará (se convertirá en otros tipos de tejidos) para formar diferentes estructuras de cabeza y cuello. En los humanos, se forman cinco arcos.
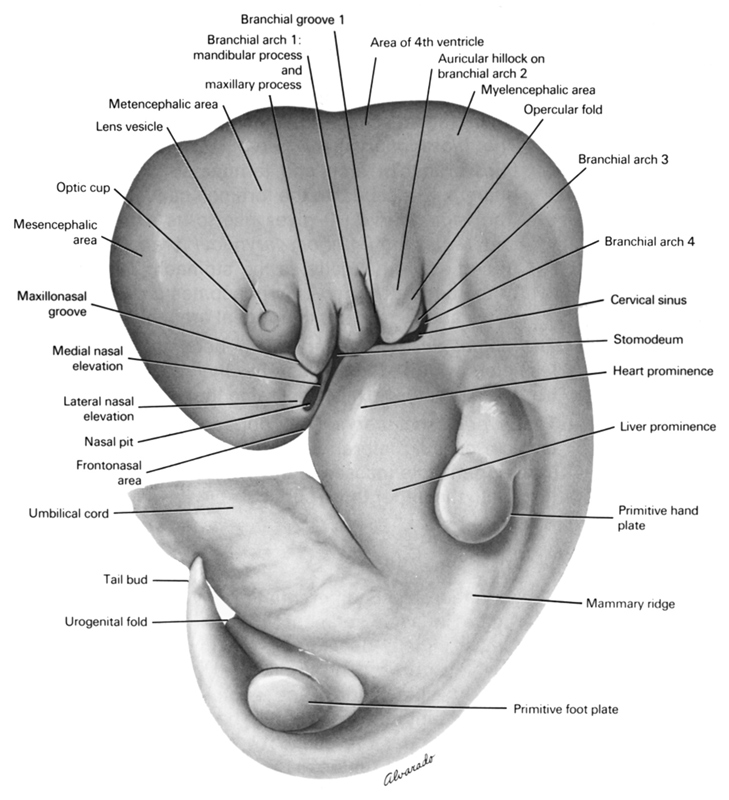
| Embrión humano de cinco semanas con 10 mm de tamaño. Créditos:The virtual Human Atlas. |
El arco 1 da origen a un cartílago específico, llamado cartílago de Meckel.
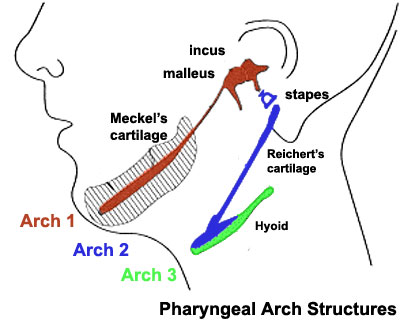
| Créditos: Embryology online education and research website. |
Esta introducción se realizó para enmarcar el siguiente estudio de Laurence Legeai-Mallet et al.: Meckel's and condylar cartilages anomalies in achondroplasia result in defective development and growth of the mandible, (Las anomalías de Meckel y los cartílagos condilares en la acondroplasia dan como resultado un desarrollo y un crecimiento defectuosos de la mandíbula) HMG Advance Access publicado el 3 de junio de 2016.
"El crecimiento mandibular se basa en gran medida en los cartílagos primarios y secundarios. El cartílago de Meckel (CM) es un cartílago primario en forma de barra que atraviesa el proceso mandibular del primer arco faríngeo y actúa como una plantilla para la osificación membranosa del cuerpo mandibular".
Este estudio es una secuencia de la publicación del primer estudio de NVP-BGJ398.
"La activación de las mutaciones del FGFR3 en humanos produce acondroplasia (ACH), la forma más frecuente de enanismo, donde los cartílagos se ven gravemente alterados y causan defectos en: los huesos largos, la base craneal y las vértebras. Dado que el desarrollo y el crecimiento mandibular dependen de los cartílagos que guían o participan directamente en el proceso de osificación, estudiamos el impacto de las mutaciones del FGFR3 en la forma, el tamaño y la posición de la mandíbula."
"Mostramos que las mutaciones en las funciones de ganancia del FGFR3 llevan a anomalías estructurales de los cartílagos de la mandíbula, primarios (de Meckel) y secundarios (condilares), lo que da como resultado una hipoplasia y una dismorfogénesis mandibular".
"Estos defectos están probablemente relacionados con una proliferación y diferenciación de condrocitos defectuosos".
"El inhibidor pan-FGFR NVP-BGJ398 de la tirosina quinasa corrige los defectos ex vivo de los cartílagos condilar y de Meckel. Además, mostramos que dosis bajas de NVP-BGJ398 mejoran el crecimiento del cóndilo in vivo y corrigen las dismorfologías en ratones Fgfr3 Y367C/+, lo que sugiere que el tratamiento posnatal con ratones NVPBGJ398 podría ofrecer una nueva estrategia terapéutica para mejorar las anomalías de la mandíbula en la acondroplasia y otros trastornos relacionados con el FGFR3".
Las principales observaciones de este estudio fueron las siguientes:
- La acondroplasia tiene como resultado hipoplasia mandibular y dismorfogénesis.
- La activación del FGFR3 en ratones tiene como resultado hipoplasia mandibular y dismorfogénesis.
- La homeostasis de los condrocitos es alterada en el cartílago de Meckel de ratones Fgfr3 Y367C/+
- La activación del FGFR3 reduce el crecimiento condilar en humanos y en ratones.
- La inhibición de la tirosina quinasa corrige los defectos de los cartílagos primario y secundario en los embriones Fgfr3 Y367C/+.
- La inhibición de la tirosina quinasa mejora la dismorfogénesis mandibular y el tamaño del cóndilo en ratones Fgfr3 Y367C/+
Este estudio es otra afirmación de que el nuevo NVP-BGJ398 puede ser un tratamiento en potencial para la acondroplasia, pero es necesario investigar mucho más sobre esto. En términos de especificidad para el FGFR3 (este compuesto no es elegible si afecta otras enzimas que son importantes durante el desarrollo natural de un niño con acondroplasia), toxicidad, disponibilidad y efectividad para acceder a la placa de crecimiento en pacientes con acondroplasia.


