Noticias de última hora – Datos Preliminares de la Fase para el TransCon CNP
El presidente y el director ejecutivo de Ascendis Pharma, declaró que "los datos de TransCon CNP presentados por primera vez indican que nuestro producto candidato arrojó una exposición continua de CNP en los niveles objetivo durante siete días, respaldando la administración de una vez por semana. Creemos que TransCon CNP está bien adaptado para enfrentar los desafíos de las personas que viven con acondroplasia y ofrece una nueva opción terapéutica potencial que ve más allá de la estatura, para abordar las comorbilidades asociadas. Esperamos avanzar con este programa en ensayos clínicos, para niños que viven con acondroplasia, el próximo año, 2019". Las noticias completas y la presentación de los datos preliminares de la Fase 1 están en la página web de Ascendis Pharma.

| Créditos - Ascendis Pharma (datos preliminares fase 1). |
Ensayo clínico Fase 1
Fue:
Diseño de la Fase 1

| Diseño de la fase 1 - créditos - Ascendis Pharma (datos preliminares de la fase 1) |
El ensayo incluyó a 45 sujetos adultos sanos de 2 centros de estudio en Australia, que se dividieron en diferentes grupos. Se probaron secuencialmente cinco dosis de TransCon CNP, comenzando con la dosis más baja: 3.0, 10, 25, 75 y 150 microgramos/kg. Se asignaron al azar hasta 10 sujetos en cada cohorte de dosis para recibir ya sea el TransCon CNP o el placebo en una proporción de 4: 1. Después de que cada cohorte completó la dosis, una Junta de Monitoreo de Seguridad de Datos (DSMB por sus siglas en inglés) revisó los datos cegados para aprobar el aumento a la siguiente dosis más elevada.
El punto final primario fue la frecuencia de eventos adversos después de la administración de TransCon CNP.
Los puntos finales secundarios incluyeron parámetros de seguridad adicionales, tolerabilidad y farmacocinética.
Resultados preliminares de seguridad de TransCon CNP
Los aspectos clave de los datos presentados por Ascendis fue que no se reportaron eventos adversos graves ni efectos secundarios no deseados en el ensayo.
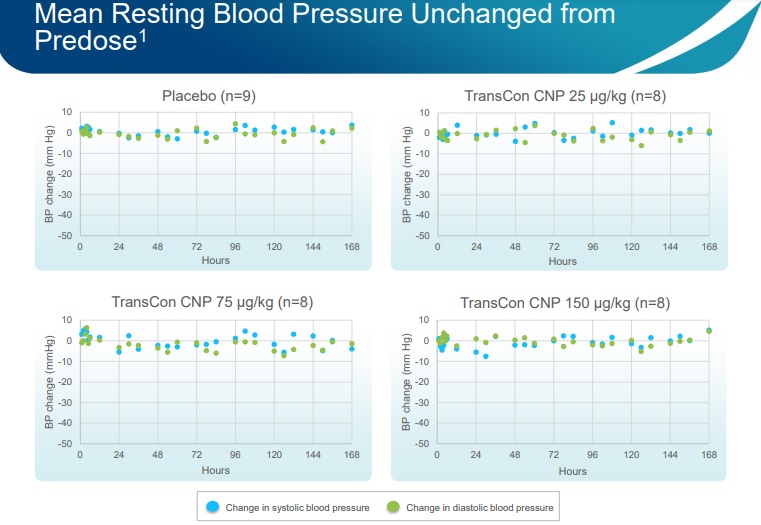
Además, la compañía reportó que TransCon CNP fue de un modo general bien tolerado en dosis de hasta 150 µg/kg. Comparado con un compuesto similar, la Vosoritida, actualmente en la fase 3, se está administrando en una dosis de 15 µg/kg/ día, en relación con la presión arterial media en reposo y la frecuencia cardíaca (la cual es tomada cuando una persona no está haciendo ninguna actividad) no varió la pre dosis en todos los tiempos, en todas las cohortes. Este es también un aspecto importante, en comparación con la Vosoritida, que produce cambios no serios, transitorios (es decir, por minutos) y se resuelve sin intervención médica, reduciendo la presión arterial y la frecuencia cardíaca.
Además, Ascendis informó que las inyecciones fueron bien toleradas en todas las cohortes de dosis sin eventos adversos notificados.
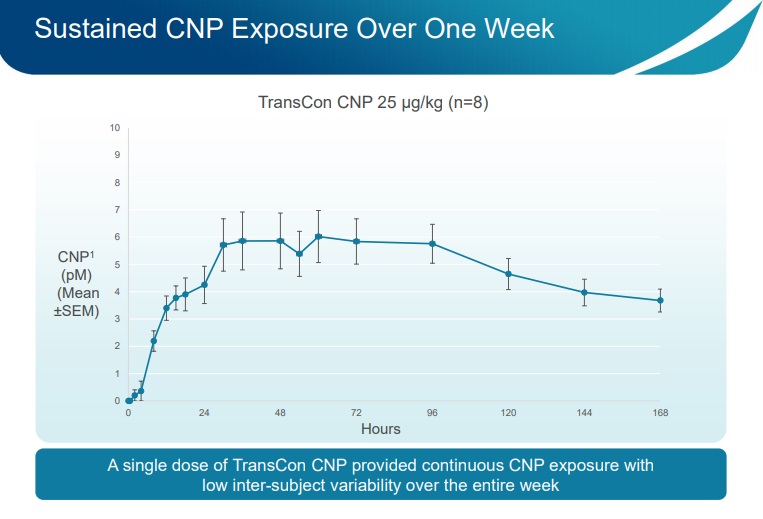
Principales conclusiones
- Los datos de TransCon CNP fase 1 reprodujeron el perfil de la Farmacocinética (PK) y la seguridad cardiovascular de los estudios preclínicos.
Esta declaración muestra que los resultados obtenidos ahora están en la misma línea de los resultados obtenidos previamente en el modelo de ratón.
- Fue confirmada una administración subcutánea única (inyección de TransCon CNP) por semana, basada en los valores continuos de CNP durante siete días.
- Los niveles continuos de CNP son importantes para equilibrar las vías de CNP/FGFR3 y para normalizar el crecimiento.
- Generalmente bien tolerado en todas las cohortes.
- La posibilidad de un impacto significativo en la vida de los pacientes, no solo afectando su estatura sino también abordando muchas comorbilidades asociadas con la acondroplasia.
Presentación completa de Ascendis Pharma


