Investigación sobre el ARQ 087, un inhibidor de la tirosina quinasa
En 2016, el equipo de investigación dirigido por el Dr. Pavel Krejci publicó el siguiente artículo:
Multikinase activity of fibroblast growth factor receptor (FGFR) inhibitors SU5402, PD173074, AZD1480, AZD4547 and BGJ398 compromises the use of small chemicals targeting FGFR catalytic activity for therapy of short-stature syndromes. (La actividad multiquinasa de los inhibidores del receptor del factor de crecimiento de fibroblastos (FGFR) SU5402, PD173074, AZD1480, AZD4547 y BGJ398 compromete el uso de pequeños productos químicos dirigidos a la actividad catalítica de FGFR para el tratamiento de síndromes de baja estatura). Gudernova I, Vesela I Balek L, Buchtova M, Dosedelova H, Kunova M, Pivnicka J, Jelinkova I, Roubalova L, Kozubik A, Krejci P.
Convirtiendo este título en algo comprensible, los investigadores dijeron que los 5 agentes/productos (SU5402, PD173074, AZD1480, AZD4547 y BGJ398), conocidos como TKIs (inhibidores de la tirosina quinasa) mostraron grandes resultados en el bloqueo de los FGFRs de las tirosina quinasas en las placas de cultivo de células (placas donde los investigadores pusieron células específicas en un cultivo para ser probado). La imagen de abajo es un ejemplo de una placa de cultivo celular.
| Cultivo de tejidos. Créditos: Ferentis |
Existen 4 tipos de Receptores de Factor de Crecimiento de Fibroblastos (FGFR, por sus siglas en inglés): FGFR1, FGFR2, FGFR3 y FGFR4, y sus acciones (denominadas señales) son distintivas e involucran diferentes y múltiples procesos biológicos, los cuales incluyen proliferación celular, supervivencia, diferenciación, migración y apoptosis durante el desarrollo embrionario y la homeostasis del tejido adulto. [5, 7]
El FGFR 3 es el receptor donde se encuentra la mutación de la acondroplasia en los condrocitos y, sabiendo que los TKIs pueden bloquear el FGFR3, ellos también pueden bloquear los demás FGFRs. Esto significa que no solamente los FGFR3 son TKIs sino todos o casi todos los FGFR.
Es un regulador fisiológico negativo importante del crecimiento óseo y, por lo tanto, un inhibidor del FGFR3 seguro y eficaz que sin duda revolucionaría el tratamiento de los síndromes de baja estatura en general, posiblemente incluyendo muchos que no están relacionados con el FGFR3 [3].
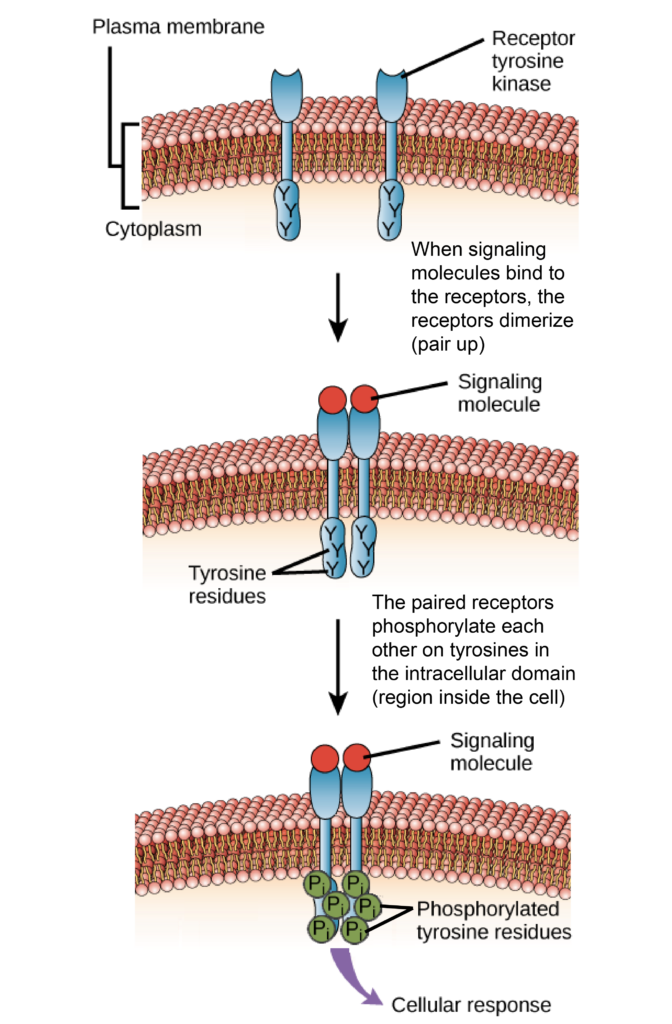
| Créditos: Khan Academy. |
Fue entonces, que en 2016, el equipo llegó a la conclusión de que los 5 TKIs de FGFR evaluados eran malos candidatos para el tratamiento de la acondroplasia, principalmente porque los TKIs mostraban una significativa actividad fuera del objetivo. ¿Qué significa esto? Los TKIs carecen de especificidad para el FGFR3, atacan a los demás FGFR y muestran una toxicidad celular que podría comprometer el uso de los TKIs para el tratamiento para la acondroplasia [3].

| Créditos: 401KSpecialist. |
Aunque los inhibidores de la tirosina quinasa (TKIs por sus siglas en inglés) han revolucionado el tratamiento de ciertas formas de cáncer, y estos agentes son generalmente bien tolerados, la experiencia clínica con ellos ha destacado su asociación inesperada con graves efectos tóxicos en diferentes órganos como ser: corazón, pulmones, hígado, riñones, tiroides, piel, coagulación sanguínea, tracto gastrointestinal y sistema nervioso. Esto ocurre porque las tirosina quinasas se encuentran ampliamente distribuidas con roles funcionales específicos en diferentes órganos [2].
Recientemente, en agosto de 2017, el mismo equipo publicó:
El ARQ 087 inhibe la señalización de FGFR y rescata la proliferación y diferenciación celular aberrante en modelos experimentales de craneosinostosis y condrodisplasias causadas por la activación de mutaciones en los FGFR1, FGFR2 y FGFR3 .
El ARQ 087 es un inhibidor de la tirosina quinasa que ha sido probado en condrocitos cultivados (placas celulares de cultivo), en las que el equipo observó que el ARQ 087 rescató de manera eficiente todos los efectos principales de la activación patológica del FGFR3 como ser la inhibición de la proliferación de condrocitos, la pérdida de la matriz extracelular y la inducción de la senescencia (envejecimiento) prematura. Esto significa que en los condrocitos cultivados que poseen la mutación de la acondroplasia y el ARQ 087, los condrocitos podrían crecer y multiplicarse como lo hacen en una placa de crecimiento típica. Desafortunadamente, el ARQ 087 también tiene una acción fuera del objetivo y bloquea el FGFR1, el FGFR2 y el FGFR3.
La principal conclusión del estudio es la siguiente:
"Los efectos de los TKIs competitivos con ATP fuera del objetivo representan un obstáculo importante que compromete su uso en la clínica, a pesar del hecho de que incluso los efectos secundarios graves pueden ser tolerados en el cáncer, donde el objetivo principal es la supervivencia del paciente. Por el contrario, los efectos colaterales pueden no ser aceptables en la acondroplasia o en la craneosinostosis, donde los principales objetivos del tratamiento son respectivamente: aumentar la estatura y corregir el desarrollo craneal desproporcionado". [4]
Esta investigación demuestra que los TKIs no son una selección adecuada para tratar la acondroplasia.
El desarrollo de nuevos estudios para la acondroplasia puede ser muy exigente y requerir de mucho tiempo, pero los pacientes confían en que los investigadores hagan lo mejor que puedan para obtener resultados que, en última instancia, podrían convertirse en un tratamiento y reducir las complicaciones originadas por la acondroplasia: la desproporcionalidad de las extremidades y el tronco, los problemas neurológicos y respiratorios, las complicaciones ortopédicas, la imagen social negativa, entre otros temas que son preocupaciones y plantean problemas a lo largo de la vida.
No todos los estudios originarán un nuevo medicamento, pero la mayoría de ellos ayudará a los investigadores a decidir cuál camino tomar y cuál no.
Comentario del autor: el título y el texto de esta publicación fueron modificados después de la reconsideración del contenido anterior.
Fuentes
- http://www.tuftsctsi.org/about-us/what-is-translational-science/
- Shah DR, Shah RR, Morganroth J. Tyrosine kinase inhibitors: their on-target toxicities as potential indicators of efficacy. Drug Saf. 2013 Jun;36(6):413-26.
- Gudernova I, Vesela I, Balek L, Buchtova M, Dosedelova H, Kunova M, Pivnicka J, Jelinkova I, Roubalova L, Kozubik A, Krejci P. Multikinase activity of fibroblast growth factor receptor (FGFR) inhibitors SU5402, PD173074, AZD1480, AZD4547 and BGJ398 compromises the use of small chemicals targeting FGFR catalytic activity for therapy of short-stature syndromes. Hum Mol Genet. 2016 Jan 1;25(1):9-23.
- Balek L, Gudernova I, Vesela I, Hampl M, Oralova V, Bosakova MK, Varecha M, Nemec P, Hall T, Abbadessa G, Hatch N, Buchtova M, Krejci P. ARQ 087 inhibits FGFR signaling and rescues aberrant cell proliferation and differentiation in experimental models of craniosynostoses and chondrodysplasias caused by activating mutations in FGFR1, FGFR2, and FGFR3. Bone. 2017 Aug 18. pi: S8756-3282(17)30311-3.
- Kai Hung Tiong, Li Yen Mah, and Chee-Onn Leong. Functional roles of fibroblast growth factor receptors (FGFRs) signaling in human cancers. Apoptosis 2013; 18(12): 1447-1468
- http://www.the-scientist.com/?articles.view/articleNo/10487/title/The-Pressure-To-Publish-Promotes-Disreputable-Science/
- Ornitz D, Itoh N. The Fibroblast Growth Factor signaling pathway. Wiley Interdiscip Rev Dev Biol. 2015 May; 4(3): 215-266.


