[Todo el Texto Libre] La actividad del FGFR3 con la mutación de la acondroplasia
El Receptor de la Tirosina Quinasa (RTK) es un grupo de receptores de superficie celular donde se encuentra incluido el FGFR3 y representa una importante familia de genes que se ve afectada comúnmente por mutaciones y alteraciones en cánceres humanos. Todos los RTK comparten la misma composición: una unión extracelular específica del ligando, un dominio transmembrana de un solo paso y un dominio intracelular de tirosina quinasa.

| Figura 1 - Créditos: "Factores de crecimiento de los fibroblastos y sus receptores en el cáncer"- Biochemical journal, 2011 (Revista bioquímica, 2011). |
El complejo formado por 2 FGFs + 2 FGFRs (más 2 cadenas de heparán sulfato) causa dimerización y una reacción en cadena dentro de la célula, llamadas cascadas de señalización aguas abajo. La dimerización del FGFR3 forma un dímero (una estructura química formada a partir de dos subunidades similares). La mutación de la acondroplasia se produce en una porción del FGFR3, el dominio transmembrana.
El concepto de dimerización podría ser más fácil de visualizar con el siguiente ejemplo: palillos chinos.
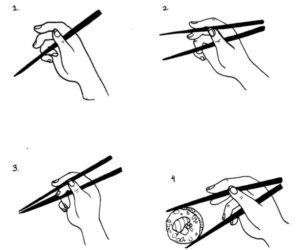
| Image credits |
Imaginemos que cada porción de FGFR3 es un palillo. Cuando una persona sostiene dos palillos puede producir un movimiento para juntar las puntas. Tomar comida con palillos solo es posible porque hay dos. Con uno solo, esto no sería posible.
Una acción similar ocurre cuando se activa el FGFR3: las dos partes del FGFR3 se enlazan cuando un ligando se une (volviendo a comer con los palillos, los ligandos se asociarían a la mano que los sostiene).
Supuestamente, el FGFR3 formaría solamente un dímero y comenzaría la reacción en la cadena intracelular después de la unión de ligandos, tal y como se propone en la Figura 1. Pero la mutación de la acondroplasia causa un cambio estructural en el FGFR3 que afecta la estabilidad y la actividad de los dímeros del FGFR3 incluso en ausencia del ligando. En "la mutación del FGFR3 produce una osificación membranosa anormal en la acondroplasia", Legait Mallet et al. Human Molecular Genetics, (Genética Molecular Humana) 2014
En el año 2014, Hristova et al., publicaron "Dimerización del FGFR3 en Células Vivas", Biophysic Journal (Revista Biofísica). El equipo de investigación de la Universidad Johns Hopkins desarrolló una metodología basada en FRET (por sus siglas en inglés) (Transferencia de Energía de Resonancia Fluorescente/ Förster) para medir la dimerización de los RTK en las células.
Recientemente, Sarabipour S. y Hristova K., publicaron "Efecto de la mutación de la acondroplasia en la dimerización del FGFR3 y en la respuesta estructural del FGFR3 al fgf1 y al fgf2: Un estudio cuantitativo de la Transferencia de Energía de Resonancia Fluorescente Förster en vesículas de membrana plasmática derivadas osmóticamente" en Biochim Biophys Acta., Julio 2016.
Con relación a sus estudios, la Prof. Kalina Hristova tuvo la amabilidad de responder algunas preguntas.
Preguntas y Respuestas - Beyond Achondroplasia (Más allá de la Acondroplasia) y la Prof. K. Hristova
BA - ¿Puede el FGFR3 dimerizar e iniciar la cascada corriente abajo de tirosina quinasa con y sin ligandos?
KH - Correcto, pero la actividad con y sin ligando es diferente. Esto se debe a que el dímero sufre cambios estructurales cuando el ligando se une y su actividad se incrementa. También tenga en cuenta que no hemos observado la señalización aguas abajo, solo la fosforilación de la quinasa del FGFR3.
BA - El concepto de que el FGFR3 se dimerizaría y fosforilaría solamente después de que se uniese un ligando no es correcto. Cuando el FGFR3 tiene la mutación de la acondroplasia, la dimerización es más estable y dura más tiempo. Usted afirmó que el FGFR3 + la acondroplasia se dimerizan y fosforilan incluso sin ligandos. Y que esta actividad del FGFR3 + acondroplasia dimerizado (activo) después de que NO se unen los ligandos también es más estable que el FGFR3 sin unión al ligando. ¿Podría usted confirmar esto?
KH - Sí, la mutación de la acondroplasia estabiliza el dímero no ligado
BA - ¿Llegó usted a la conclusión sobre el porcentaje de FGFR3 + acondroplasia dimerizado sin la unión de ligandos versus la unión del ligando de FGFR3 + acondroplasia dimerizado?
KH - Esto dependerá de la expresión. Puedo calcular todo esto si conozco el nivel de expresión relevante del FGFR3 en los condrocitos. He estado tratando de encontrar estos valores en la literatura.
BA - Si el FGFR3 + acondroplasia actúa sin ligandos, ¿es una ventaja la captura de ligandos (FGFs) en el espacio intercelular??
KH – Esto debería ser válido. Para el TS (tipo salvaje de FGFR3 sin mutación) y para la acondroplasia mutante, el ligando causa un cambio estructural que aumenta la actividad.
Entonces la realidad en la acondroplasia es ésta: el ligando tiene una activación dependiente e independiente.

| Figura 2 - Créditos: " Factores de crecimiento de fibroblastos y sus receptors en el cáncer"- Biochemical journal (Revista bioquímica), 2011. |
Si el FGFR3 puede producir una reacción dentro de la célula sin ligandos (esto es, de una manera muy imaginativa sería como comer sushi con los palillos sin usar una mano...), muy probablemente, un potencial tratamiento para la acondroplasia que pudiese actuar directamente sobre el FGFR3 tendría una mayor probabilidad de ser efectivo.
La Dra. Kalina Hristova tiene un nombramiento conjunto en Ingeniería Biomédica en la Escuela de Medicina de la Universidad Johns Hopkins. Es catedrática y profesora académica Marlin U. Zimmerman Jr. de la Johns Hopkins University Whiting School of Engineering (Escuela de Ingeniería Whiting de la Universidad Johns Hopkins). La Dra. Hristova obtuvo su Licenciatura y su Masterado en Ciencias en la Universidad de Sofía en Bulgaria. Su Doctorado en Ciencias lo obtuvo en la Universidad de Duke.


